گاز آمونیاک روی دو مولکول وجود دارند. نخستین آنها به شکل گاز است که از یک اتم نیتروژن و سه اتم هیدروژن تشکیل میشود. گاز آمونیاک با نام anhydrous ammoniaهم شناخته میشود که به معنی «آمونیاک بدون آب» است. آمونیاک در محیط به راحتی با آب وارد واکنش میشود; بنابراین تقریباً به هر نوع آمونیاکی که برخورد میکنیم در حقیقیت «هیدروکسید آمونیوم» است.
مولکول آمونیاک یک هسته گاز هیدروژن (یک پروتون) را از آب میرباید. این سبب تشکیل یون آمونیوم NH4+میشود و تنها چیزی که از مولکول آب باقی میگذارد یون هیدروکسیل OH -است. به دلیل این که هسته هیدروژن و مولکول آمونیاک دارای بارهای مخالف هستند; یکدیگر را جذب میکنند و در همان محدوده باقی میمانند. آمونیاک که برای مصارف خانگی به عنوان ماده تمیز کننده استفاده میشود. در واقع متشکل از آب و هیدروکسید آمونیوم است.
شما در این مطلب میخوانید.
در اوایل قرن بیستم، بشر به دنبال روشی برای تولید گاز آمونیاک به منظور افزایش باروری در محصولات کشاورزی خود بود. پس از کشف شیوه تولید انبوه آمونیاک به نامهابر، ۲ بیلیون نفر در جهان از گرسنگی نجات یافتند. در مقابل تولید سالانه ۱۰۰ میلیون تنی این ماده; نقشی اساسی را در آلودگی محیط زیست به خود اختصاص داده است.

گاز آمونیاک نیز مانند آب قلیایی (هیدروکسید سدیم) یک ماده پایه است.مانند هیدروکسید سدیم میتواند با روغنها و چربیها وارد واکنش شود تا تشکیل صابون دهد. آمونیاک به عنوان یک ماده شستشو دهنده; چربیها و روغنها را روی سطح شیشه ای یا سفالی به صابون تبدیل میکند; و آب موجود در محلول آمونیاک مواد صابونی را حل میکند; در نتیجه با استفاده از اسفنج یا دستمال کاغذی میتوان آنها را پاک کرد.چیزی که باقی میماند محلولی از هیدروکسید آمونیوم است.که کاملاً تبخیر خواهد شد و هیچ خط و اثری روی سطح باقی نخواهد گذاشت.
این مجموعه در زمینه فروش گاز آمونیاک فعالیت جدی دارد که با توجه به نیاز مشتریان اقدام به فروش می نماید. با توجه به نیاز شما مشتری عزیز ، گاز مورد نظر در سیلندر فوق شارژ خواهد شد و تحویل داده خواهد شد.
تعداد و میزان گاز مورد نیاز با توجه به درخواست مشتریان متفاوت است. قیمت گاز آمونیاک با توجه به تخصصی بودن و همچنین میزان درصد مورد نیاز متفاوت است. در این کار حرفه ای و حساس نیاز است که مشتری ارتباط مستقیم تلفنی با فروشندگان را داشته تا از مشاوره رایگان برخوردار گردد.


بسیاری از کارخانجات به توتون سیگار گاز آمونیاک اضافه میکنند. آمونیاک جذب نیکوتین در خون را تا هفت برابر افزایش میدهد. در نتیجه پنج ثانیه پس از نخستین پک به سیگار نیکوتین آن به مغز رسیده; با ترشح هورمونهایی ضربان قلب، فشارخون و قند خون را افزایش میدهد.
بدن جانوران از پروتئین موجود در غذایشان گاز آمونیاک سازی میکند. چون برای خنثی کردن اسیدهای ادرار به آمونیاک نیاز دارد. به همین دلیل است از طویلهای که حیوانات زیادی را در آن نگه میدارند; یا از یک اصطبل بوی تند آمونیاک به مشام میرسد.
وقتی بوی تنفس فردی شبیه به گاز آمونیاک است، نشان از ابتلای وی به نارسایی کلیوی دارد. کلیهها مواد زائد را از خون خارج میسازند، اما زمانی که کلیهها دچار نارسایی میشوند; حجم کمتری از مواد زائد را از خون خارج میکنند. به همین دلیل مواد زائد تولید شده در بدن از طریق سیستم تنفسی; به شکل بوی نامطبوع از بدن خارج میشوند. دهان بیماران کلیوی همواره بو و مزه آمونیاک مانند را به علت اورمی (افزایش اوره خون) در دهانشان حس می کنند; که البته این مسأله در صبح شایع تر است و از علائم اولیه بیماری کلیه به شمار میرود.

آمونیاک (NH3)، گاز بی رنگ و قهوه ای متشکل از نیتروژن و هیدروژن است. این ساده ترین ترکیب پایدار این عناصر است. به عنوان مواد اولیه برای تولید بسیاری از ترکیبات مهم نیتروژن مهم تجاری عمل می کند.
استفاده عمده از گاز آمونیاک به عنوان یک کود است. در ایالات متحده، معمولا از خاک مخازن حاوی گاز مایع به طور مستقیم به خاک اعمال می شود. گاز nh3 نیز می تواند به صورت نمک های آمونیوم; مانند نیترات آمونیوم، NH4NO3، سولفات آمونیوم، (NH4) 2SO4 و فسفات های مختلف آمونیوم باشد. اوره، (H2N) 2C = O، بیشترین منبع نیتروژن برای کود در سراسر جهان است. آمونیاک نیز در تولید مواد منفجره تجاری (به عنوان مثال، ترنیتروتوولین [TNT]، نیتروگلیسیرین و نیتروسلولوز استفاده می شود)

در صنایع نساجی، گاز آمونیاک برای تولید الیاف مصنوعی مانند نایلون و مصنوعی استفاده می شود. علاوه بر این، در رنگرزی و تمیز کردن پنبه، پشم و ابریشم استفاده می شود. آمونیاک به عنوان یک کاتالیزور در تولید برخی از رزین های مصنوعی عمل می کند. مهمتر از همه، آن را خنثی محصولات جانبی اسیدی از فرآورده های نفتی; و در صنعت لاستیک آن را از انعقاد لاتکس خام; در هنگام حمل و نقل از گیاه به کارخانه جلوگیری می کند. آمونیاک همچنین در فرایند آمونیاک سودا (که همچنین فرآیند Solvay نامیده می شود) یک روش به طور گسترده ای برای تولید خاکستر سودا و روش Ostwald; یک روش برای تبدیل آمونیاک به اسید نیتریک، کاربرد دارد.

آمونیاک در فرآیندهای مختلف متالورژی، از جمله نیتریدینگ صفحات آلیاژی برای سخت کردن سطوح آنها استفاده می شود. از آنجایی که آمونیاک می تواند به راحتی تجزیه شده به تولید هیدروژن; یک منبع قابل حمل هیدروژن اتمی برای جوشکاری است. علاوه بر این، آمونیاک می تواند; مقادیر قابل توجهی از گرما را از محیط اطراف خود جذب کند (مثال، یک گرم آمونیاک جذب 327 کالری گرما) که باعث می شود آن را به عنوان یک خنک کننده در تجهیزات تبرید و تهویه مطبوع مفید باشد. در نهایت، در میان استفاده های جزئی آن شامل در برخی از عوامل پاک کننده خانگی است.
گاز آمونیاک خالص توسط دانشمند انگلیسی جوزف پریستلی در سال 1774 تهیه شد. ترکیب دقیق آن توسط شیمی کریستال فرانسوی Claude-Louis Berthollet در سال 1785 تعیین شد. آمونیاک به طور مداوم در میان پنج ماده شیمیایی تولید شده در ایالات متحده قرار دارد. روش اصلی تجاری آمونیاک تولید توسط فرایند هابر بوش است که شامل واکنش مستقیم هیدروژن و نیتروژن عنصری.

این واکنش نیاز به استفاده از کاتالیزور، فشار بالا (100-1000 اتمسفر) و درجه حرارت بالا (400-550 درجه سانتیگراد) [750-1020 درجه فارنهایت] دارد. در واقع، تعادل بین عناصر و آمونیاک کمک به تشکیل آمونیاک در دمای پایین; اما درجه حرارت بالا برای رسیدن به میزان رضایت بخش آمونیاک مورد نیاز است. چند کاتالیزور مختلف می توان استفاده کرد. به طور معمول کاتالیزور آهن حاوی اکسید آهن است. با این حال، هر دو اکسید منیزیم بر روی اکسید آلومینیوم; که توسط اکسید فلزات قلیایی و روتنیم روی کربن فعال شده اند, به عنوان کاتالیزورها استفاده شده است. در آزمایشگاه، آمونیاک به واسطه هیدرولیز نیترید فلز، بهترین ترکیب است
گاز آمونیاک یک گاز بی رنگ با بوی تیز و نفوذ است. نقطه جوش آن -33.35 درجه سانتی گراد (-28.03 درجه فارنهایت) و نقطه ی انجماد آن -77.7 درجه سانتیگراد (-107.8 درجه فارنهایت) است. این دارای حرارت بالا تبخیر است (23.3 کیلوجول در هر مول در نقطه جوش) و می تواند به عنوان مایع در ظروف حرارتی عایق در آزمایشگاه مورد استفاده قرار گیرد. (گرمای تبخیر ماده یک کیلووژول است که نیاز به تبخیر یک مول از ماده بدون هیچ تغییری در درجه حرارت دارد.) مولکول آمونیاک دارای شکل یاتاقان مثلثی با سه اتم هیدروژن و یک جفت الکترون نامشخص متصل به اتم نیتروژن این مولکول قطبی است و به دلیل اتصال قوی هیدروژنی بین مولکولی به شدت وابسته است.
ثابت دی الکتریک آمونیاک (22 در -34 ° C [-29 ° F]) پایین تر از آب (81 در 25 درجه سانتیگراد [77 درجه فارنهایت] است)، بنابراین آن را یک حلال برای مواد آلی است. با این حال، هنوز هم به اندازه کافی به اندازه کافی اجازه می دهد که آمونیاک به عنوان یک حلال یونیزه کننده نسبتا خوب عمل کند. آمونیاک نیز خود یونیزه می شود، اگر چه کمتر از آب است
احتراق گاز آمونیاک با مشکل مواجه است، اما گاز و آب نیتروژن را تولید می کند. 4NH3 + 3O2 + حرارت → 2N2 + 6H2O با این حال; با استفاده از کاتالیزور و تحت شرایط صحیح درجه حرارت; آمونیاک با اکسیژن به تولید اکسید نیتریک، NO; که به دی اکسید نیتروژن NO2 اکسید شده است، و در سنتز صنعتی اسید نیتریک.
آمونیاک به راحتی با آزاد شدن گرما در آب حل می شود این محلول های آبی آمونیاک پایه هستند. گاهی اوقات به عنوان راه حل های هیدروکسید آمونیوم (NH4OH) نامیده می شوند. با این حال، تعادل این است; محلول 1.0 مولار NH3 فقط 4.2 میلی مول هویج یون هیدروکسید را فراهم می کند. هیدرات NH3 • H2O، 2NH3 • H2O، و NH3 • 2H2O وجود دارد و نشان داده شده است; که شامل آمونیاک و مولکول های آب مرتبط با پیوند های هیدروژنی بین مولکولی.
آمونیاک مایع به طور گسترده به عنوان یک حلال غیر آبی استفاده می شود. فلزات قلیایی و همچنین فلزات سنگین قلیایی خاک و حتی برخی از فلزات داخلی; در آمونیاک مایع حل می شوند و باعث تولید محلول های آبی می شوند. اندازه گیری های فیزیکی، از جمله مطالعات الکتریکی هدایت، شواهدی را نشان می دهد; این رنگ آبی و جریان الکتریکی به علت الکترون متضاد است. فلز (NH3) x ⇌ M + (NH3) x + e- (NH3) y ;این محلولها منبع عالی الکترون برای کاهش سایر مواد شیمیایی هستند.
همانطور که غلظت فلزات حل شده افزایش می یابد، محلول به رنگ آبی عمیق تر تبدیل می شود. در نهایت به یک محلول مسی رنگ با یک بلستر فلزی تغییر می کند. هدایت الکتریکی کاهش می یابد و شواهدی وجود دارد; الکترون های حل شده برای تشکیل جفت الکترون متصل می شوند. 2e- (NH3) y ⇌ e2 (NH3) y
. NH3 + H2O ⇌ NH4 + + OH-
فرمول و ساختار: فرمول شیمیایی آمونیاک NH3 است و جرم مولی آن 17.03 g / mol است.
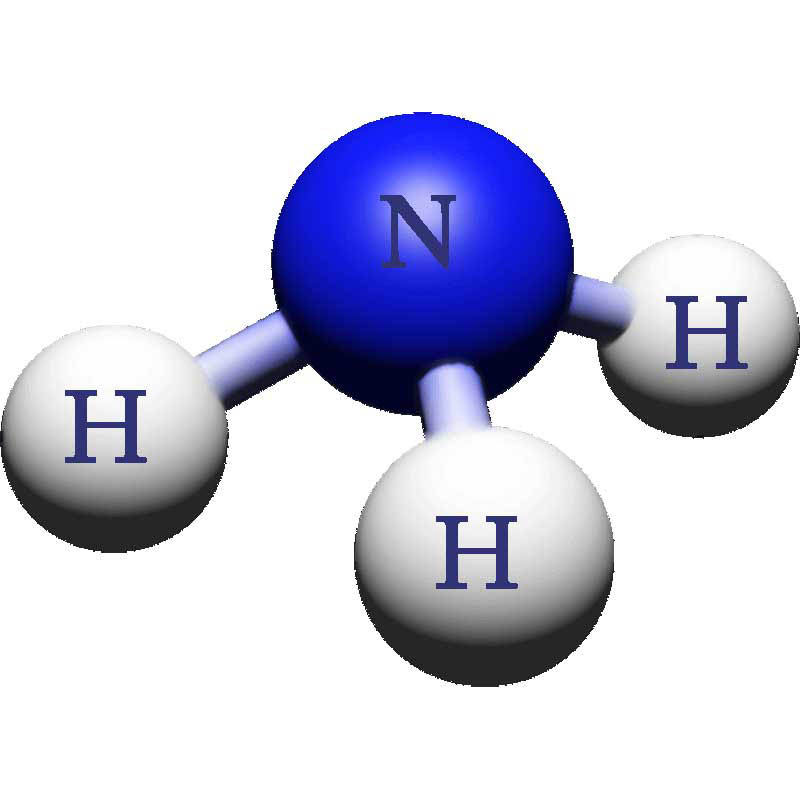
مولکول آمونیاک دارای شکل یاتاقان مثلثی است که نیتروژن به سه اتم هیدروژن متصل است. اتم نیتروژن یک جفت الکترون تنها دارد که آمونیاک را پایه می گذارد. NH3 یک مولکول قطبی است که به راحتی پیوند های هیدروژنی را تشکیل می دهد; و باعث می شود که با آب بسیار متبلور شود.
گاز آمونیاک به طور طبیعی در بدن رخ می دهد. از طریق کلیه ها به منظور خنثی کردن اسید بیش از حد ترشح می شود. همچنین در مقادیر کم در آب باران، مناطق آتشفشانی و حتی جو موجود است.
گاز آمونیاک به صورت تجاری در فرایند هابر بوش تولید می شود. در آن هیدروژن و نیتروژن عنصری در حضور کاتالیزور فلزی واکنش داده می شود تا گاز آمونیاک را واگذار کند. واکنش با فشار بالا و درجه حرارت بالا (400-550 درجه سانتیگراد) انجام می شود.
N2 + 3H2 → 2NH3
گاز آمونیاک یک گاز بی رنگ با بوی تیز و نفوذ است. نقطه جوش آن -33.35 درجه سانتی گراد است و نقطه انجماد آن -77.7 درجه سانتی گراد است. گاز NH3 می تواند مایع شود، با این حال، به دلیل نقطه بسیار جوش آن; مایع آمونیاک باید در دمای پایین و فشار بالا ذخیره شود.
آمونیاک پایه ضعیف است. این ترکیب با اسید های مختلف برای تشکیل نمک های آمونیوم، که مواد شیمیایی مهم در بسیاری از صنایع است. آمونیاک به طور واضح در واکنش اکسوترمی واکنش داده می شود تا محلول آمونیوم آبی را; که همچنین به عنوان هیدروکسید آمونیوم (NH4OH) نامیده می شود، تشکیل دهد.
NH3 + H2O → NH4OH
آمونیاک مایع یک حلال مهم غیر آبی است. می تواند بسیاری از فلزات قلیایی و قلیایی خاک را برای تولید راه حل های رسانایی آبی حل کند.
آمونیاک پیشرونده از ترکیبات مختلف مهم نیتروژن مانند اوره، اسید آمینه، فنل، آکریلونیتریل; سیانور هیدروژن، خاکستر سودا، اسید نیتریک و بسیاری دیگر است. همچنین برای تولید کود، پلیمر، الیاف مصنوعی (نایلون، مصنوعی)، مواد منفجره (TNT، نیتروگلیسیرین)، مواد تمیزکننده و مبرد استفاده می شود.
اگر چه در طبیعت به طور گسترده ای در دسترس است و برای بسیاری از خانوارها مورد استفاده قرار می گیرد; آمونیاک به وسیله استنشاق سمی در نظر گرفته می شود. گازهای NH3 دارای بوی تیز و تند است که می تواند به طور چشمگیری چشم، بینی; غشای مخاطی و پوست را تحریک کند و به دستگاه تنفسی صدمه بزند. در غلظت های بالا، قرار گرفتن در معرض گاز آمونیاک باعث آسیب دائمی ریه و مرگ می شود
چه چیزی در آب تاثیر می گذارد؟ عوامل طبیعی که می توانند بر میزان غلظت آمونیاک تأثیر بگذارند عبارتند از:
جنبه های دیگر دوچرخه سواری نیتروژن همچنین می تواند مقدار آمونیاک موجود را تحت تأثیر قرار دهد.
آمونیاک همچنین می تواند از آلودگی داخلی، صنعتی یا کشاورزی، عمدتا از کود، ماده آلی یا ماده مدفوع باشد.
آمونیاک مهمترین ترکیب هیدروژن ازت است و در طبیعت از تجزیهٔ مواد آلی ازت دار بدست میآید. آمونیاک گازی است بی رنگ، با مزهٔ فوق العاده تند و زننده که اشکآور و خفه کننده است. گاز آمونیاک از هوا سبک تر بوده و به سهولت به مایع تبدیل میشود. آمونیاک درآب بسیار محلول بوده; در منفی ۷۷/۷ درجهٔ سانتیگراد منجمد و در منفی ۳۳/۳۴ درجهٔ سانتیگراد به جوش در میآید. وزن مخصوص محلول اشباع آمونیاک ۰/۸۸ گرم بر سانتیمتر مکعب است. گاز آمونیاک قابل افروزش و حدود اشتعالش ۱۶-۲۵ درصد حجمی گاز آمونیاک در هوا است.
حضور مواد نفتی و دیگر مواد افروختنی خطر آتشگیری را افزایش میدهد. مجاورت و تماس آمونیاک با نقره و جیوه تولید ” فورمینات نقره و جیوه ” میکند که موادی شدیداً قابل انفجار هستند. گاز آمونیاک در اثر گرمای از ۴۰۰ درجه به بالا تجزیه شده و تولید هیدروژن میکند.
آمونیاک سبب تحریکات دستگاه تنفسی، پوست و چشم شده و با آسیب رساندن به ششها; در اثر مواجهه با حجم زیاد این گاز میتواند سبب مرگ شود. رومیهای باستان آمونیوم کلراید را به عنوان پول و سپرده استفاده می کردند. آنها سنگ آمونیوم را از مکانی به نام پرستشگاه ژوپیتر یا همان لیبی جدید جمع آوری می کردند. اما آمونیاک به شکل نمک آمونیاک نخستین بار توسط شیمیدانان جابرابن حیان (شیمیدان ایرانی) Geber در قرن ۸ شناخته شد.
آمونیاک در کارخانجات یخ سازی ، در ساخت کودهایی از قبیل نیترات; سولفات و فسفات آمونیوم ، تهیه اسید نیتریک ، دارو و مواد منفجره بکار میرود. محلول آمونیاکی که معمولا در تجارت ، خرید و فروش میشود; 20 تا 22 درجه سوم (20.7 درصد و تکاتف نسبی آن (d=0,92 و یا 28 تا 29 درجه; (32.7 درصد آمونیاک) میباشد.
آمونیاک را میتوان اصولا از سه منبع زیر تهیه کرد:
آمونیاک از دو عنصر پدید آمده است:
۱-ازت یا نیتروژن
۲-هیدروژن
از آمیختن این دو گاز بهم آمونیاک فراهم می شود. بدین طریق که ازت را از هوا و هیدروژن را از آب بدست می آورند. سپس آنها را خشک و فشرده می کنند و تا ۵۴۰ درجه سانتی گراد حرارت می دهند. آنگاه آنها را از روی مخلوطی از نمک های گوناگون عبور می دهند. در این مرحله ازت و هیدروژن با هم می آمیزند و آمونیاک بوجود می آید.

سنگینی یا « چگالی » گاز آمونیاک به اندازه ی ۰/۳۳۳۳۳۳۳ سنگینی هواست. اگر آنرا فشرده و سپس سرد کنند به مایع بیرنگی تبدیل می شود. این مایع بیرنگ بسیار شبیه آب است ولی ۱/۵ درجه زیر صفر می جوشد.
هرگاه فشار وارد بر آمونیاک مایع را کاهش دهیم دوباره به صورت گاز در می آید. در این صورت آمونیاکی که دوباره به گاز تبدیل شده گرمای بیشری به خود جذب می کند. برای همین است که آمونیاک را در تهیه ی یخ و سردسازی به کار می برند .
در منزل نیز می توان آمونیاک را با آب رقیق مخلوط کرد تا از آن «آمونیاک خانگی » بدست آید. این نوع آمونیاک برای شستشو و لکه گیری مفید خواهد بود. اگر آمونیاک را با اسید ها بیامیزیم نمک های آمونیوم به دست می آیند.
بسیاری از این نمک ها بسیار مفیدند. مثلاً کلرور آمونیوم برای لحیم کاری بکار می رود. از آن در ساختن پیل خشک و دارو نیز استفاده می شود.
سولفات آمونیوم یکی از کود های قیمتی به شمار می رود.
نیترات آمونیوم در ساختن کود و هم در ساختن مواد منفجره به کار می رود.
نمک های بودار دارای کربنات آمونیوم هستند.
اگر چه برخی از نمک های آمونیوم در طبیعت بوجود می آیند. ولی ما خود می توانیم آمونیاک را با مقداری معینی اسید ترکیب کنیم و چنین نمک هایی را بدست آوریم .
در گذشته آمونیاک از گازهای سازندهاش( نیتروژن و اکسیژن) تولید می شده است.
آمونیاک از واکنش کلسیم سیانامید با بخار آب تحت فشار نیز تولید میشد.
عیب این روش صرف انرژی فراوان می باشد و برای تولید آمونیاک صرفه اقتصادی ندارد.
اما امروزه آمونیاک در صنعت از واکنش مستقیم هیدروژن و نیتروژن به دست میاید. بیشتر آمونیاک مصرفی از روش سنتز و مقداری هم به عنوان فرآورده جانبی برخی از فرآیندهای شیمیایی تولید می شود.
فریتز هابـر در حدود ۹۰ سال پیش; در کالسروهه آلمان فرآیند سنتز آمونیاک را با استفاده هیدروژن و نیتروژن انجام داد. این فرآیند با اسلوبمند کاتالیزور و کاربرد آن به وسیله میتاش(Mittasch) ادامه پیدا کرد; در نهایت و در طی چندین سال توسط بوش(Bosch) محقق گردید. حال نیزبیش از ۹۰ درصد ازآمونیاک تولید شده در جهان با فرآیند معروف هـابـرـ بوش (Haber_ Bosch ) تولید می شود که در طی سالها توسعه و تکمیل یافته است.
نمکهای آمونیاکی که از تقطیر زغال سنگ بدست میآیند، بر دو نوعند:
نمکهای ثابت و غیر فرار مانند کلرید آمونیوم NH4Cl و هیپوسولفیت S2O3(NH4)2 و غیره. بوسیله باز غیر فراری مانند آهک تجزیه میگردند.
ضمنا باید متذکر شد، آمونیاکی که از تقطیر یک تن زغال سنگ حاصل میشود; طبعا با مقدار ازت موجود در زغال متغیر است و این مقدار بین ۱,۴ کیلوگرم تا ۴,۶ کیلوگرم نوسان دارد. بهندرت در بعضی از انواع زغال سنگها این مقدار به ۷,۲ کیلوگرم میرسد.
معمولا هرگاه عمل تقطیر زغال سنگ را در مجاورت ۲,۵ درصد آهک انجام دهند; بهره آمونیاک تا ۲۰ درصد افزایش نشان میدهد و به هر صورت; میتوان در دستگاههای خنک کننده از قطرانهایی که همراه آنها میباشند. جدا کرد و اصطلاح صنعتی این قبیل محلولهای آمونیاکی را آبهای آمونیاکی مینامند; که آنها را ابتدا در ستونی تقطیری وارد میکنند. سپس تحت تاثیر شیر آهک قرار میدهند. در آنجا آمونیاک و املاح فرار آنها بوسیله بخار آب برده میشوند; در حالیکه املاح غیر فرار تحت تاثیر شیر آهک ، تجزیه و به آمونیاک تبدیل میگردند.
آمونیاک گازیست قابل اشتعال و حدود اشتعالش ۱۶ تا ۲۵ درصد حجمی گاز آمونیاک در هوا میباشد. حضور مواد نفتی و دیگر مواد قابل اشتعال، خطر حریق را افزایش میدهند. محلول غلیظ اکسید نقره از محلول آمونیاک حل شده و تولید فولمینات نقره به فرمول CNOAg مینماید; که ماده ای شدیداً قابل انفجار است. همچنین گاز آمونیاک در اثر حرارت از ۴۰۰ درجه به بالا تجزیه شده ، تولید هیدروژن مینماید.

سبب تحریکات سیستم تنفسی، پوست و چشم شده و با آسیب رساندن به ریهها; در اثر مواجهه با حجم زیاد این گاز میتواند سبب مرگ شود. در صورت تماس با آمونیاک مایع، سوختگی شدید در محل تماس ایجاد میگردد. آستانه مجاز مواجهه با آن ، ppm 50 است و جهت کمکهای اولیه; قسمتهای آلوده سطح بدن را با آب و صابون شسته; چشمها را نیز با آب فراوانی شستشو داد و به پزشک مراجعه نمود.
در صورتیکه سیلندر گاز آمونیاک مشتعل شد، نباید شعله آن را خاموش نمود; مگر اینکه قبلاً بتوان جریان گاز را قطع کرد. در حین عملیات اطفاء، باید سیلندرهای حاوی گاز آمونیاک را با آب خنک نمود. از پودر شیمیایی خشک یا گاز کربنیک یا آب بهصورت اسپری جهت اطفاء میتوان استفاده نمود. به هنگام عملیات باید از لباس کاملاً ایمن و سیستم حفاظتی دستگاه تنفس استفاده کرد.
گاز آمونیاک باید در سیلندرهای استیل نگهداری و توسط تانکرهای مخصوص آن حمل گردد. باید سعی نمود از رسیدن تنشهای فیزیکی و حرارت زیاد به ظروف محتوی آمونیاک جلوگیری شود. انبار و محل نگهداری آن باید مقاوم در برابر حریق بوده و دارای سیستم اعلام و اطفاء اتوماتیک باشد. آمونیاک باید جدا از موادی چون گازهای اکسید کننده ، کلر ، برم ، ید و اسیدها نگهداری شود.

ازت به صورتهای نیترات ،یون آمونیم و اوره قابل جذب گیاه است. فرم اصلی ازت در خاک بوده و فرمهای، و پس از مدتی کم و بیش کوتاه بصورت در می آیند. تبدیل این فرمها به موجب آزاد شدن گشته و pH خاک را نقصان می دهد. ازت موجود در کودها را بصورت درصد ازت خالص ذکر می نمایند. نیترات آمونیم ۳۳ درصد ازت داشته و هر دو فرم ازت آن قابل جذب گیاه می باشند. چون دارای بار منفی است جذب کلوئیدهای خاک نشده و در معرض شستشو از خاک است. اما چون دارای بار مثبت است جذب کلوئیدهای خاک می گردد و بتدریج بصورت در می آید. اوره رایج ترین کود ازت در ایران است. اوره از ترکیبات آلی بشمار رفته و به همین فرم قابل جذب گیاه می باشد.
از محلول اوره در محلول پاشی برگ گیاهان نیز استفاده میشود. اوره نیترات آمونیم را می توان قبل از کاشت محصول; بصورت سرک و بعد از آن که گیاه مقداری رشد نمود به خاک داد. سولفات آمونیم علاوه بر ازت دارای ۲۴ درصد گوگرد است. هیدرات آمونیم را که از حل شدن آمونیاک در آب بدست می آید; قبل از کاشت بوسیله سرنگهای مخصوص در زیر لایه ای از خاک قرار می دهند.
آمونیاک مایع دارای درصد زیادی ازت است. آمونیاک مایع را در بشکه های تحت فشار حمل نموده و توسط سرنگهای مخصوصی در خاک تزریق می کنند. محلول آمونیاک و بخصوص آمونیاک مایع را می بایستی در خاک مرطوب تزریق نمود; تا در محلول خاک حل شده و در خاک به خوبی توزیع گردد. همچنین تراکم خاک مرطوب امکان پذیر بوده و نتیجتاً از فرار آمونیاک جلوگیری شود. کودهای اوره، هیدرات آمونیم و آمونیاک مایع برای خاکهای دارای pH بیشتر از ۸ مناسب نیستند. در این گونه خاکها ازت این کودها بصورت گاز آمونیاک در آمده و از خاک خارج می گردد.
نیترات کلسیم و نیترات پتاسیم درصد ازت کمی داشته وکمتر بعنوان منبع کود ازت در خاک مصرف می شوند. این کودها غالباً در محلولهای غذایی بعنوان منابع کلسیم یا پتاسیم مورد استفاده قرار می گیرند.
آمونیاک در تولید راه حل های کود مایع استفاده می شود; که شامل آمونیاک، نیترات آمونیوم، اوره و آمونیاک آبی است. همچنین برای تولید نمک های آمونیوم و نیترات از سوی صنعت کود نیز استفاده می شود.
چرا آمونیاک در دمای مایع در حالت مایع نیست. اگر هیدروژن را مانند آب تشکیل دهد؟ استحکام پیوند هیدروژن به دلیل اکسیژن تشکیل شده بیشتر از نیتروژن است. مقایسه آن با آمونیاک که می تواند تنها یک پیوند هیدروژنی را در هر مولکول تشکیل دهد
گاز آمونیاک (NH3) قلیایی است زیرا به راحتی پروتون (H +) را برای تشکیل یک کاتیون آمونیوم (NH4 +) می گیرد. این به نوبه خود مقدار باقی مانده یون های هیدروکسید (-OH) را افزایش می دهد. که باعث افزایش قلیایی می شود. و از این رو طبیعت اساسی است
آمونیاک یک پایه ضعیف است زیرا اتم نیتروژن آن یک جفت الکترون دارد که به راحتی پروتون را می پذیرد. همچنین، هنگامی که در آب حل می شود; آمونیاک یون های هیدروژن را از آب به دست می دهد تا یون های هیدروکسید و آمونیوم تولید کنند. تولید این یون های هیدروکسید است که آمونیاک را بنیاد مشخصه آن می گذارد
اگر آن درون پوست شما وارد شود، باعث سوختگی پوست می شود. اگر شما آن را در معرض هوا قرار دهید و در ناخودآگاه و ریه های شما به وجود می آید. این چیزی است که معمولا شما را بکشند, اگر گاز آمونیاک متمرکز را وارد کنید.
مجموعه کپسول گاز در راستای وظایف شغلی در زمینه گاز ها توانسته است گاز امونیاک را در سیلندر با سایز های مختلف ارائه نماید. شارژ کپسول آمونیاک یکی از سیلندر هایی است که در زمینه کاری این مجموعه می باشد . ما فروشنده سیلندر آمونیاک می باشیم ولی باید در کنار فروش اقدام به خدمات رسانی نماییم تا مشتریان پس از خرید نگرانی نداشته باشند.
شارژ مجدد گاز آمونیاک در سیلندر را انجام خواهیم داد و بر اساس تعداد درخواست مشتریان می توانیم اقدامات لازم جهت هماهنگی را انجام داده تا بتوانیم مخازن شما را به کارخانه منتقل نماییم.
شارژ سیلندر آمونیاک اغلب در مخازن بزرگ مورد درخواست مشتریان خواهد بود. از آمونیاک به عنوان کود ممکن است در مخازن بزرگتر از سیلندر مورد استفاده قرار بگیرد.
ما توانسته ایم در زمینه شارژ امونیاک فعالیت نموده و خدماتی را در این راستا برای هموطنان عزیزمان انجام دهیم.
ترکیب گاز امونیاک با توجه به درخواست مشتری و البته رعایت نکات ایمنی و قابلیت میکس بودن اقدام به انجام آن خواهیم نمود که رعایت درخواست های مشتری با توجه به درصد های ارائه شده صورت خواهد پذیرفت.
برای استفاده از این گاز نیاز به برخی از تجهیزات خواهید داشت که در این بخش به آنان اشاره خواهیم نمود و همچنین شما می توانید با کلیک بروی هر کدام به مشاهده محصول مورد نظر هدایت شوید.
مجموعه ما برای تهیه درخواست های شما آمادگی کافی را ...
بیشتر بخوانیدتوجه به خواننده: این برگه اطلاعاتی برای ارائه آگاهی عمومی ...
بیشتر بخوانید