گاز اکسیژن, گاز فشرده و اکسیژن مایع را در انواع خلوص و غلظت ارائه می دهیم. گاز اکسیژن علاوه بر استفاده از آن به عنوان یک گاز تنفسی توسط صنعت مراقبت های بهداشتی; اکسیژن دارای ویژگی های اکسید کننده قوی است; که می تواند به بهبود بخشیدن به عملکرد; بهینه سازی عملکرد و کاهش هزینه ها کمک بسیاری به صنایع داشته باشد. برنامه های کاربردی مانند احتراق، اکسیداسیون و تخمیر می توانند; از طریق غنی سازی یا جایگزینی پروسه های هوا با اکسیژن سود ببرند.
تیم های کاربردی با تجربه ما در سراسر جهان می توانند از دانش صنعت و کاربرد خود استفاده کنند. تا شما را با یک راه حل اکسیژن و فاضلاب فشرده و مایع; برای پاسخگویی به نیازهای منحصر به فرد خود بسازند.
شما در این مطلب میخوانید.

گاز اکسیژن یکی از عناصر فراوان در این سیاره است. فضای ما 21٪ اکسیژن عنصر آزاد است. اکسیژن نیز به طور گسترده در ترکیبات در پوسته زمین، مانند آب (89٪) و اکسید معدنی ترکیب شده است. حتی بدن انسان 65 درصد اکسیژن را با وزن دارد.
اکسیژن عنصر آزاد به طور طبیعی به عنوان یک گاز در فرم مولکول های دوامدار O2 رخ می دهد.
گاز اکسیژن دارای بسیاری از خواص فیزیکی و شیمیایی منحصر به فرد است. به عنوان مثال، اکسیژن یک گاز بی رنگ و بی بو است; با تراکم بیشتری نسبت به هوا و یک حلالیت بسیار کم در آب است. در حقیقت، دو خواص دوم تا حد زیادی باعث جمع آوری اکسیژن در این آزمایشگاه می شوند. از جمله ویژگی های شیمیایی منحصر به فرد اکسیژن; توانایی آن برای حمایت از تنفس در گیاهان و حیوانات و توانایی آن برای حمایت از احتراق است.
در این آزمایشگاه، اکسیژن به عنوان یک محصول تجزیه پراکسید هیدروژن تولید خواهد شد. یک کاتالیزور برای سرعت بخشیدن به سرعت واکنش تجزیه (بدون مصرف توسط واکنش) مورد استفاده قرار می گیرد. که در غیر این صورت به عنوان یک منبع اکسیژن بسیار کند است. کاتالیست خاصی که در اینجا استفاده می شود فعال مخمر است.
اکسیژن عنصر شیمیایی با علامت O و عدد اتمی 8 است. یکی از اعضای گروه کلکوژن در جدول تناوبی. یک فلز غیرمولد بسیار واکنشی و یک عامل اکسید کننده است. به راحتی اکسیدها را با اکثر عناصر و همچنین ترکیبات دیگر تشکیل می دهد. با جرم، اکسیژن سومین عنصر فراوان در جهان پس از هیدروژن و هلیوم است. در دمای و فشار استاندارد، دو اتم عنصر برای تشکیل dioxygen; یک گاز دیاتومیک بدون رنگ و بدون بو با فرمول O2. گاز اکسیژن دیاتومیک 20.8٪ از جو زمین را تشکیل می دهد. به عنوان ترکیبات از جمله اکسید، این عنصر تقریبا نیمی از پوسته زمین را تشکیل می دهد.
Dioxygen در تنفس سلولی مورد استفاده قرار می گیرد. بسیاری از کلاس های اصلی مولکول های آلی موجود در موجودات زنده حاوی اکسیژن; مانند پروتئین، اسیدهای نوکلئیک، کربوهیدرات ها و چربی هستند. همچنین ترکیبات معدنی عمده پوسته های حیوانات، دندان ها و استخوان ها را تشکیل می دهند. اکثر توده موجودات زنده اکسیژن را به عنوان جزء آب تشکیل می دهند. اکسیژن به طور فزاینده فتوسنتز در جو زمین به کار می رود که از انرژی نور خورشید; برای تولید اکسیژن از آب و co2 استفاده می کند.
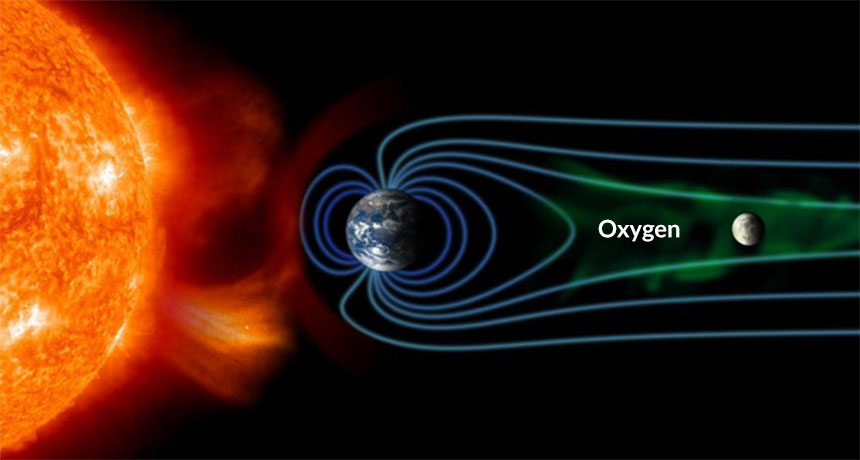
اکسیژن از لحاظ شیمیایی واکنش پذیر است. تا یک عنصر آزاد در هوا باقی بماند بدون اینکه به طور مداوم توسط اثر فتوسنتزی موجودات زنده شود. یکی دیگر از شکل (الیوتروپ) اکسیژن، ازن (O3) اشعه ماوراء بنفش UVB به شدت جذب می کند و لایه اوزون در ارتفاع بالا; به محافظت از بیوسفر از اشعه ماوراء بنفش کمک می کند. با این حال; ازن موجود در سطح یک محصول جانبی دود است و بنابراین یک آلاینده است.

اکسیژن توسط مایکل شنیدویوویج قبل از سال 1604 جدا شده است. اما معمولا اعتقاد بر این است; که این عنصر به طور مستقل توسط کارل ویلهلم Scheele، در اوپسالا در سال 1773 یا قبل; و جوزف Priestley در ویلتشایر در سال 1774 کشف شد. اغلب اولویت برای Priestley به دلیل او کار اول منتشر شد. پریستلی، با این حال، اکسیژن را “هوا ضعیف” نامید و آن را به عنوان یک عنصر شیمیایی شناخت. نام آن اکسیژن در سال 1777 توسط Antoine Lavoisier ساخته شد; که ابتدا اکسیژن را به عنوان عنصر شیمیایی شناخته و به درستی نقش آن در احتراق را مشخص می کند.
استفاده معمول از اکسیژن شامل:
یکی از نخستین آزمایش های شناخته شده در رابطه بین احتراق و هوا; توسط نویسنده یونانی پیش از میلاد بر روی مکانیک فیلو بیزانس انجام شد. در کار خود را Pneumatica، فیلو مشاهده کرد که معکوس یک کشتی; بیش از یک شمع در حال سوختن و اطراف گردن این کشتی; با آب منجر به برخی از آب در حال افزایش را به گردن. فیلو نادرست تصور می کرد که قسمت هایی از هوا در کشتی به آتش سوزی کلاسیک تبدیل شده; و در نتیجه می توان از طریق حفره های شیشه ای فرار کرد. چندین قرن بعد، لئوناردو داوینچی با تأکید بر اینکه بخشی از هوا; در طی احتراق و تنفس مصرف می شود، بر روی کار فیلو ساخته شده است.
رابرت هوک، Ole Borch، میخائیل لومونسوف و پییر باین اکثریت را در آزمایشات قرن هفدهم و هجدهم تولید کردند. اما هیچکدام از آنها آن را به عنوان یک عنصر شیمیایی شناختند. این ممکن است بخشی به دلیل شایع فلسفه احتراق و خوردگی به نام نظریه فلوژیستون; که پس از آن توضیح مورد علاقه از آن فرآیندها بود.
تئوری phlogiston اعلام کرد که تمام مواد قابل احتراق از دو بخش ساخته شده است. در سال 1667 توسط جیمز بکهر، کیمیاگر آلمانی J. J. Becher و توسط شیمی جیمز Georg Ernst Stahl اصلاح شده است. یکی از قسمت هایی که فلوژیستون نامیده می شد. هنگامی که ماده حاوی آن سوخته بود، تخلیه شد; در حالی که بخش ضدمیکولیت آن به شکل واقعی آن یا کلسیم بود.
به نظر میرسد که مواد بسیار قابل احتراق; که باقی مانده کمتری از قبیل چوب یا ذغال سنگ را به وجود می آورند. بیشتر از فلوژیستون است؛ مواد غیر قابل احتراق که خوردگی می کنند، مانند آهن، بسیار کم است. هوا در نظریه فلوژیستون نقش نداشت و هیچ آزمایشی کمتری برای آزمایش این ایده انجام نشد; در عوض، آن را بر اساس مشاهدات از آنچه اتفاق می افتد زمانی که چیزی می سوزد; که اکثر اشیاء رایج ظاهر می شود; سبک تر و به نظر می رسد در چیزی از دست دادن در روند.
یک نقاشی از یک سالمند مرد نشسته روی یک میز و موازی با نقاشی. بازوی چپ خود را بر روی یک نوت بوک نگه می دارد، پاها عبور می کنند.
جوزف پریستلی معمولا در کشف اولویت دارد.
کیمیاگر فیلسوف لهستان و پزشک مایکل شنیدویوویوس در اثر خود; De Lapide Philosophorum Tractatus duodecim e naturae fonte et manuali experientia depromti (1604) مواد تشکیل دهنده موجود در هوا را با اشاره به آن به عنوان “cibus vitae” (غذا زندگی توصیف کرد) ، و این ماده با اکسیژن مشابه است.
Sendivogius، در طول آزمایش های خود بین 1598 و 1604 انجام شده است; به درستی به رسمیت شناخته شده است; که ماده معادل محصول جانبی گازاجرا آزاد شده توسط تجزیه حرارتی از نیترات پتاسیم است. در نظر بوگایز، جداسازی اکسیژن و اتصال مناسب ماده به آن بخشی از هوا که برای زندگی ضروری است; برای کشف اکسیژن توسط Sendivogius به اندازه کافی وزن می دهد. این کشف اسنیدوویج، اغلب، توسط نسل های دانشمندان و شیمیدانانی که او را پی گرفت، انکار می کرد
نمودار مدار پس از بارت (2002) نشان می دهد که اوربیتال های اتمی شرکت کننده از هر اتم اکسیژن; اوربیتال های مولکولی که از همپوشانی آنها حاصل می شود. پر کردن آئوفوبو از اوربیتال ها با 12 الکترون، 6 از هر اتم O; شروع از کمترین انرژی های موجود در اوربیتال و به دست آوردن شخصیت دوگانه کووالانتی از اوربیتال های پر شده. (و لغو سهم جفت های σ و σ * و π و π * جفت اربیتال) است.

در دمای و فشار استاندارد، اکسیژن یک گاز بی رنگ، بی بو و بی مزه با فرمول اکسیژن مولکولی O است.
به عنوان dioxygen نامیده می شود.
به عنوان dioxygen، دو اتم اکسیژن به طور شیمیایی به یکدیگر متصل هستند. پیوند می تواند بر اساس سطح تئوری متفاوت باشد; اما به طور منطقی و ساده به عنوان یک پیوند دوگانه کوانتومی; که از پر شدن اوربیتال های مولکولی تشکیل شده; از اوربیتال های اتمی اتم های اکسیژن فردی است; پر می شود که در نتیجه یک پیوند منظور از دو به طور خاص; پیوند دوگانه نتیجه حاصل از انرژی متوالی کم انرژی و یا Aufbau; پر کردن اوربیتال ها و از بین بردن کمک های انجام شده از الکترون های 2s; پس از پر شدن ترتیبی از اربیتال های کم σ و σ * است. σ همپوشانی دو اوربیتال 2p اتمی که در امتداد محور مولکولی OO قرار دارد.
π همپوشانی دو جفت اوربیتال اتم 2p عمود بر محور مولکولی OO است. پس از آن، لغو سهم از دو الکترون از شش الکترون 2p; پس از پر شدن جزئی آنها از کمترین ارگانیسم های π و π *.
این ترکیبی از لغوها و همپوشانی σ و π موجب می شود; شخصیت دو واکنش و واکنش پذیری و وضعیت پایه الکترونیکی سه گانه باشد. یک پیکربندی الکترون با دو الکترون ناپیوسته، همانطور که در اوربیتالهای dioxygen یافت می شود. (اربیتال های π * پر شده در نمودار را ببینید) که از انرژی برابر است، یعنی منحنی – یک پیکربندی است که حالت سه گانه اسپین نامیده می شود. از این رو، وضعیت زمین O2 مولکول به عنوان مولکول اکسیژن سه گانه نامیده می شود.
بیشترین انرژی، اوربیتال هایی که به صورت جزئی پر شده اند، ضدبدون هستند. بنابراین پر شدن آنها باعث می شود که ترتیب اتصال از 3 تا 2 کاهش یابد. به علت اینکه الکترونهای ناسازگار آن، اکسیژن سه گانه با بیشتر مولکولهای آلی; که دارای چرخش الکترون هستند، به آرامی واکنش نشان می دهند. این از احتراق خود به خود جلوگیری می کند.
اکسیژن مایع، به علت پارامغناطیس آن به طور موقت در یک آهنربا معلق است.
در فرم سه گانه O2 مولکول پارامغناطیس است. به عبارت دیگر، به علت لحظات مغناطیسی چرخشی مغناطیسی در الکترونها در مولکول; و انرژی مبادله منفی بین همسایگی O2 مولکول. اکسیژن مایع به طوری مغناطیسی است که در تظاهرات آزمایشگاهی; پل اکسیژن مایع ممکن است در برابر وزن خود بین قطب یک آهنربا قوی تقویت شود.
اکسیژن یکپارچه نامی است که به چند گونه انرژی بالایی از O مولکولی داده می شود.
که در آن تمام الکترونها چرخش می کنند. این بسیار واکنش بیشتری نسبت به مولکول های آلی معمولی نسبت به اکسیژن مولکولی دارد. در طبیعت، گاز اکسیژن مجزا معمولا از آب در فتوسنتز، با استفاده از انرژی نور خورشید تشکیل شده است. همچنین در تروپوسفر توسط فوتولیز ازن توسط نور طول موج کوتاه تولید می شود. توسط سیستم ایمنی بدن به عنوان منبع اکسیژن فعال تولید می شود. کاروتنوئید ها در موجودات فتوسنتز (و احتمالا حیوانات) نقش مهمی در جذب انرژی از اکسیژن مجزا; و تبدیل آن به حالت زمین بی تحرک دارند تا از آسیب رساندن به بافت ها جلوگیری کنند.
روش های ذخیره سازی گاز اکسیژن شامل مخازن اکسیژن با فشار بالا، کربوژن ها و ترکیبات شیمیایی است. به علت اقتصاد، اکسیژن اغلب به صورت مایع در تانکرهای مخصوصا عایق شده حمل می شود. زیرا یک لیتر اکسیژن مایع به 840 لیتر اکسیژن گاز در فشار اتمسفر و 20 درجه سانتیگراد (68 درجه فارنهایت) معادل است. از جمله این تانکرها برای پر کردن مخازن ذخیره سازی اکسیژن مایع مجزا; که خارج از بیمارستان ها و موسسات دیگری هستند. که نیاز به حجم زیادی از گاز اکسیژن خالص دارند، استفاده می شود. اکسیژن مایع از مبدلهای حرارتی عبور میکند تا قبل از ورود به ساختمان مایع فریزر را به گاز تبدیل میکند. اکسیژن نیز در سیلندرهای کوچکتر حاوی گاز فشرده ذخیره و حمل می شود. یک فرم که در برنامه های کاربردی قابل حمل پزشکی قابل استفاده و جوشکاری و برش اکسیژن مفید است.
کاربرد O2 به عنوان یک گاز تنفس کم فشار در فضای مدرن است. که بدن خود را با گاز تنفسی بدن خود را احاطه کرده است. این دستگاه ها با استفاده از اکسیژن تقریبا خالص حدود یک سوم فشار طبیعی را به وجود می آورند. به این ترتیب، فشار جزئی عادی خون O می شود
این ترکیب کردن غلظت اکسیژن بالاتر برای فشار پایین برای حفظ انعطاف پذیری مورد نیاز است.

2. زیردریایی ها و لباس های غواصی جوی معمولا در فشار اتمسفر طبیعی عمل می کنند. هوای تنفسی از طریق استخراج شیمیایی از دی اکسید کربن پوشیده شده و اکسیژن جایگزین شده است; تا فشار جزئی ثابت را حفظ کند. غلظت فشار محیطی، مخلوط هوا و گاز را با یک کسر اکسیژن مناسب برای عمق عملیات، نفوذ می کند. خالص یا تقریبا خالص O استفاده از غواصی در فشارهای بالاتر از اتمسفر معمولا به بازسازی کننده محدود می شود. و یا فشردگی در عمق نسبتا کم عمق (~ 6 متر عمق یا کمتر) و یا درمان های پزشکی در اتاق های بازسازی در فشار تا 2.8 بار; جایی که سمیت اکسیژن حاد بدون خطر غرق شدن می تواند مدیریت شود. غواصی عمیق نیاز به رقت زیاد O دارد.
با گازهای دیگر، مانند نیتروژن یا هلیوم، برای جلوگیری از سمیت اکسیژن.
افرادی که از کوه صعود می کنند و یا پرواز می کنند. در هواپیما های بدون فشار تحت فشار قرار دارند، گاهی مکمل O هستند.
اکسیژن (O)، عنصر شیمیایی غیر فلزی گروه 16 (VIa، یا گروه اکسیژن) جدول تناوبی. اکسیژن یک گاز بی رنگ، بی بو، بی کیفیت است که برای موجودات زنده ضروری است. که توسط حیوانات مورد استفاده قرار می گیرد و آن را به دی اکسید کربن تبدیل می کند; گیاهان به نوبه خود از co2 به عنوان منبع کربن استفاده می کنند و اکسیژن را به اتمسفر می رسانند. اکسیژن ترکیبات را با واکنش با عمق هر عنصر دیگر; و همچنین واکنش هایی که عناصر را از ترکیب آنها با یکدیگر جدا می کنند تشکیل می دهد; در بسیاری از موارد، این فرآیندها با تکامل گرما و نور همراه هستند; و در چنین مواردی احتراق نامیده می شوند. مهمترین ترکیب آن آب است.
گاز اکسیژن در حدود 1772 توسط یک شیمیدان سوئدی کارل ویلهلم Scheele کشف شد. توسط گرم کردن نیترات پتاسیم، اکسید گلیکول و بسیاری از مواد دیگر به دست آورد. شیمیدان انگلیسی، جوزف پریستلی، به طور مستقل اکسیژن را در سال 1774 توسط تجزیه حرارتی اکسید جیوه کشف کرد. یافته های خود را در همان سال، سه سال پیش از انتشار Scheele منتشر کرد. در سال 1775-80، آنتین لوران لووئیسیر، شیمیدان فرانسوی، با درک قابل توجهی; نقش اکسیژن را در تنفس و همچنین احتراق تفسیر کرد. از نظریه فلوژیستون، که تا آن زمان پذیرفته شده، رد شد. او تمایل خود را برای ترکیب اسیدها با ترکیب بسیاری از مواد مختلف نامید
و به همین ترتیب عنصر اکسیژن (oxygene) از واژه یونانی برای “اسید سابق” نام گرفت.
در 46 درصد از جرم، اکسیژن عنصر فراوان در پوسته زمین است. نسبت اکسیژن به حجم در جو 21 درصد و وزن در آب دریا 89 درصد است. در سنگها این ترکیب با فلزات و غیر فلزات به شکل اکسیداتی است که اسیدی هستند. (مانند گوگرد، کربن، آلومینیوم و فسفر) و یا اساسی (مانند کالسیوم، منیزیم و آهن) و به عنوان ترکیبات نمکی که ممکن است از اکسید اسید و اسید تشکیل شده باشد. به عنوان سولفات، کربنات، سیلیکات، آلومینات و فسفات تشکیل شده است. به طور گسترده ای، این ترکیبات جامد به عنوان منابع اکسیژن مفید نیست. زیرا جداسازی عنصر از ترکیبات تنگ آن با اتم های فلزی بسیار گران است.
در طی تنفس، حیوانات و بعضی از باکتریها از اتمسفر اکسیژن را جذب می کنند; و دی اکسید کربن را به آن بازگردان می کنند. در حالی که از طریق فتوسنتز، گیاهان سبز; در حضور نور خورشید جذب دی اکسید کربن و اکسیژن آزاد می شوند. تقریبا تمام اکسیژن آزاد در جو به علت فتوسنتز است. حدود 3 عدد اکسیژن به صورت حجمی در 100 قسمت آب شیرین در دمای 20 درجه سانتیگراد (68 درجه فارنهایت) در آب دریا کمی کاهش می یابد. اکسیژن حل شده برای تنفس ماهی و سایر حیوانات دریایی ضروری است
اکسیژن طبیعی ترکیبی از ایزوتوپهای پایدار است:
طولانی ترین عمر، اکسیژن 15 (نیمه عمر 124 ثانیه).
اکسیژن دارای دو فرم آلوتروپیک، دو قطبی (O2) و سه اتمی (O3، اوزون) است. خصوصیات فرم دیاتومیک نشان می دهد که شش الکترون اتم ها را پیوند می دهند; دو الکترون به صورت ناقص باقی می مانند, که به دلیل پارامغناطیس اکسیژن است. سه اتم در مولکول اوزون در یک خط مستقیم دروغ نمی گویند.
فرآیند، همانطور که نوشته شده است، endothermic (انرژی باید ارائه شده به آن را ادامه دهید) تبدیل ازن به اکسیژن دوتوم توسط حضور فلزات گذار یا اکسید های آنها افزایش می یابد. اکسیژن خالص تا حدودی به وسیله یک تخلیه الکتریکی خاموش به ازن تبدیل می شود. واکنش نیز با جذب نور ماوراء بنفش از طول موج حدود 250 نانومتر. (نانومتر، نانومتر، برابر با 10 تا 9 متر) حاصل می شود؛ وقوع این فرایند در اتمسفر فوقانی باعث حذف تابش می شود; که برای زندگی روی سطح زمین مضر است. بوی شدید ازن در مناطق محصور که در آن جرقه ی تجهیزات الکتریکی مانند; اتاق های ژنراتور وجود دارد قابل توجه است.
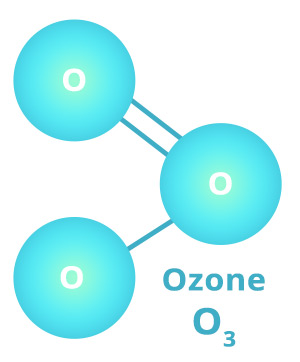
ازن آبی روشن است; ترااوزون عامل اکسید کننده قوی است که قادر به تبدیل گاز so2 به سولفور تری اکسید; سولفید به سولفات، یدید به ید (ارائه روش تحلیلی برای تخمین آن) و بسیاری از ترکیبات ارگانیک به مشتقات اکسیژن مانند آلدئید ها و اسیدها است. تبدیل ازون هیدروکربنها از گازهای خروجی خودرو به این اسیدها و آلدئیدها باعث ایجاد حساسیت مضر می شود. از لحاظ تجاری، ازن به عنوان یک ماده شیمیایی، به عنوان یک ضد عفونی کننده، در درمان فاضلاب; تصفیه آب، و پارچه های سفید کننده استفاده می شود. کم آن 1.658 برابر هوا است. نقطه جوش آن -112 درجه سانتی گراد (-170 درجه فارنهایت) در فشار اتمسفر است.
روش تولید برای اکسیژن بستگی به مقدار عنصر مورد نظر دارد.
معادلات شیمیایی
تجزیه کلرات پتاسیم توسط اکسید فلزات انتقالی کاتالیز می شود; دی اکسید منگنز (pyrolusite، MnO2) اغلب استفاده می شود. دمای لازم برای تکامل اکسیژن توسط کاتالیزور از 400 ° C تا 250 ° C کاهش می یابد.
معادلات شیمیایی
Scheele و Priestley از اکسید جیوه (II) در تهیه اکسیدان خود استفاده کردند.
معادلات شیمیایی
یک روش تجاری اولیه برای جداسازی اکسیژن از اتمسفر یا برای تولید پراکسید هیدروژن; به شکل گیری پراکسید باریم از اکسید بستگی دارد، همانطور که در معادلات نشان داده شده است.
تولید و استفاده تجاری
در صورت نیاز در مقادیر تناوبی، اکسیژن توسط تقطیر هوا مایع آماده می شود. اکسیژن دارای بالاترین نقطه جوش است و به همین دلیل است که از نیتروژن و آرگون کمتر فرار است. این روند از این واقعیت استفاده می کند. وقتی گاز فشرده مجاز به گسترش است، آن را سرد می کند. مراحل عمده در عملیات عبارتند از:
تقسیم بندی چندگانه یک محصول به اندازه کافی (99.5 درصد) برای بیشتر مقاصد صنعتی تولید می کند.
صنعت فولاد بزرگترین مصرف کننده اکسیژن خالص در “دمیدن” فولاد کربن بالا است. یعنی اینکه دی اکسید کربن و دیگر ناخالصی های غیر فلزی را در یک فرایند سریعتر و راحتتر کنترل میکند; تا اینکه از هوا استفاده شود. درمان فاضلاب با اکسیژن، وعده ای برای درمان مؤثرتر از پساب مایع می دهد تا سایر پروسه های شیمیایی. سوزاندن ضایعات در سیستم های بسته با استفاده از اکسیژن خالص اهمیت دارد. به اصطلاح LOX سوخت های اکسید کننده موشک اکسیژن مایع است. مصرف LOX بستگی به فعالیت برنامه های فضایی دارد. اکسیژن خالص در زیردریایی ها و زنگ های غواصی استفاده می شود.
هوای صنعتی اکسیژن یا غنی شده با اکسیژن هوا معمولی را در صنایع شیمیایی; جایگزین برای تولید مواد شیمیایی کنترل شده با اکسیداسیون به عنوان استیلن، اتیلن اکسید و متانول جایگزین کرده است. کاربردهای پزشکی اکسیژن شامل استفاده در چادرهای اکسیژن، استنشاق و انکوباتورهای کودکان است. بیهوشی گازدار غنی شده با اکسیژن حامی حیات در طول بیهوشی عمومی است. اکسیژن در تعدادی از صنایع که از کوره استفاده می کنند، قابل توجه است.
مقادیر بزرگ الکترونگاتیوی و وابستگی الکترون به اکسیژن نمونه هایی از عناصر هستند; که تنها رفتار غیرمولیدی را نشان می دهند. در تمام ترکیبات آن; اکسیژن حالت اکسیداسیون منفی را به عنوان انتظار می رود از دو اوربیال نهایی پر از بیرونی. هنگامی که این اوربیتالها با انتقال الکترون پر می شوند، اکسید یون O2 ایجاد می شود. در پراکسیدها (گونه هایی حاوی یون O22-) فرض می شود که هر اکسیژن یک بار -1 دارد. این ویژگی پذیرش الکترونها با انتقال کامل یا جزئی یک عامل اکسید کننده را تعریف می کند.
هنگامی که یک عامل با یک ماده اهدا کننده الکترون واکنش می دهد، وضعیت اکسیداسیون خود کاهش می یابد. تغییر (کاهش)، از حالت صفر تا -2 در مورد اکسیژن، کاهش نامیده می شود. اکسیژن ممکن است به عنوان “اصلی” عامل اکسید کننده در نظر گرفته شود; مورد استفاده برای توصیف اکسیداسیون و کاهش آن بر اساس این رفتار معمول اکسیژن است.
همانطور که در قسمت Allotropy توضیح داده شده است. اکسیژن گونه های دواتومیک، O2 را در شرایط عادی و نیز ازون OO 3 O، O3 تشکیل می دهد. شواهدی وجود دارد که نشان می دهد گونه های چهارگوشه بسیار ناپایدار O4 وجود دارد. در شکل دیاتومیک مولکولی، دو الکترون ناسازگار وجود دارد که در اوربیتال های آنتیبادی قرار می گیرند. رفتار پارامغناطیس اکسیژن حضور این الکترونها را تایید می کند.
واکنش پذیری شدید ازن گاهی توضیح می دهد که یکی از سه اتم اکسیژن در حالت اتمی است. در واکنش، این اتم از مولکول O3 جدا شده و اکسیژن مولکولی را ترک می کند.
گونه های مولکولی، O2، به خصوص در دمای طبیعی و (دمای محیط) واکنش پذیر نیستند. گونه اتمی، O، بسیار واکنش پذیر است. انرژی جداسازی (O2 → 2O) در 117.2 کیلو کالری در مول است.
گاز اکسیژن در بسیاری از ترکیبات آن، حالت اکسیداسیون -2 دارد. این یک طیف وسیعی از ترکیبات کووالانسیونی را تشکیل می دهد. که از جمله اکسید های غیر فلزی هستند مانند:
ترکیبات ارگانیک مانند: الکل، آلدئیدها و اسید های کربوکسیلیک.
اسیدهای مشترک مانند:
و نمکهای متفاوتی مانند:
اکسیژن به عنوان یون اکسید، O2- در ساختار بلوری اکسید های فلزی جامد مانند اکسید کلسیم، CaO موجود است. سوپر اکسید های فلزی مانند سوپر اکسید پتاسیم، KO2 حاوی یون O2 هستند. در حالی که پراکسید های فلزی مانند پراکسید باریم BaO2 حاوی یون O22 می باشند.
با افزایش سطح کربن در فولاد مایع; میزان اکسیژن محلول به طور نظری با توجه به رابطه٪ C ×٪ O = 0.0025 افزایش می یابد. به این معناست که، به عنوان مثال، فولاد با 0.1 درصد کربن، در تعادل; حاوی حدود 0.025 درصد و یا 250 قسمت در میلیون، اکسیژن محلول است. سطح اکسیژن محلول در فولاد مایع باید پایین باشد. زیرا اکسیژن در هنگام کشته شدن با کربن واکنش می دهد و گاز co را تشکیل می دهد. این واکنش می تواند زودتر شروع شود، در نتیجه یک مونوکسید کربن خطرناک در مایع. علاوه بر این، سطح اکسیژن بالا باعث ایجاد; بسیاری از ترکیبات اکسید می شود که برای اکثر محصولات فولادی مضر است. بنابراین، معمولا در پایان مرحله تولید فولاد، فولاد مایع با اضافه کردن آلومینیوم یا سیلیکون، بی بو می شود.
هر دو عنصر اکسید قوی هستند و با اکسیژن محلول واکنش دهند تا آلومینا (Al2O3) یا سیلیکا تشکیل دهند. اینها به سطح فولاد شناور می شوند، جایی که توسط سرباره جذب می شوند. حرکت رو به بالا این اتصالات اغلب آهسته است. زیرا آنها کوچک هستند (به عنوان مثال، 0.05 میلیمتر) و گاهی اوقات ترکیبات مختلف دی اکسیدیزرها برای تشکیل شکلهای بزرگتر که به راحتی شناور می شوند، استفاده میشود. علاوه بر این، تکان دادن ذوب با آرگون یا میدان الکترومغناطیسی اغلب به آنها اجازه می دهد تا آسانسور شوند.
بیش از نیمی از فولاد جهان در فرآیند اکسیژن پایه (BOP) تولید می شود. اکسیژن خالص برای تبدیل شارژ مایع فولاد کوره و قراضه به فولاد استفاده می شود. کوره اکسیژن پایه (BOF) یک مبدل حرارتی مقاوم در برابر انعطاف پذیر است. که در آن یک لانس آویزان به صورت عمودی متحرک; آب سرد برای وارد کردن اکسیژن از طریق نازل با سرعت فوق العاده بر روی شارژ وارد می شود. استفاده از اکسیژن خالص در جریان های بالا باعث می شود. که اکسیداسیون سریع عناصر موجود در آهن کوره انفجاری رخ دهد. که فقط در حدود 20 دقیقه در هر گرما مورد نیاز است، برای یک بار شارژ کردن. مبدل ها به اندازه ای متفاوت هستند و برای گرما اعم از 30 تا 360 تن عمل می کنند.
اکسیژن یک گاز است. این یک عنصر گازدار بی رنگ، بی مزه و بی بو که 21 درصد از اتمسفر را تشکیل می دهد. در آب، در اکثر سنگ ها و مواد معدنی و ترکیبات متعدد آلی موجود است. می تواند با تمام عناصر به جز گازهای غیر مستقیم ترکیب شود. فعال در فرایندهای فیزیولوژیکی است و به خصوص در فرآیندهای احتراق دخیل است.
این عنصر ضروری در فرآیندهای تنفسی بسیاری از سلولهای زنده است. شماره اتمی این عنصر 8 و علامت عنصری O است.
این نام از یونانی oxys به علت “تیز، اسید” به دست می آید. زیرا اکسیژن به عنوان عامل اصلی در تشکیل اسید و ژن یا ژن یونانی برای “تشکیل” شناخته می شود. شیمیدان فرانسوی Antoine-Laurent Lavoisier در اصل تصور کرد که اکسیژن اسید تولید شده است; زیرا با سوزاندن فسفر و گوگرد و حل شدن آنها در آب، او قادر به تولید اسید بود.
عناصر را می توان بر اساس حالت های فیزیکی آنها (States of Matter) طبقه بندی کرد. به عنوان مثال گاز، جامد یا مایع. این عنصر گاز است. گاز اکسیژن به عنوان یک عنصر در بخش “غیر فلزات” طبقه بندی می شود. می تواند در گروه های 14،15 و 16 جدول جدول تناوبی قرار گیرد. عناصر غیر فلزی در دمای اتاق دو در سه حالت ماده وجود دارند:
اکسیژن بسیار فراوان از همه عناصر است. این اتفاق هم در حالت آزاد و هم در حالت ترکیبی اتفاق می افتد. در حالت آزاد آن در هوا رخ می دهد. 100 حجم هوای خشک حاوی حدود 21 حجم اکسیژن است. در حالت ترکیبی هشت هشتم آب و تقریبا نیمی از سنگهایی که پوسته زمین را تشکیل می دهند. همچنین ترکیبات مهم ترکیبات گیاهی و حیوانی است؛ به عنوان مثال، حدود 66٪ از وزن بدن انسان اکسیژن است.
اکسیژن 21 درصد از اتمسفر را تشکیل می دهد.
در آب، در اکثر سنگ ها و مواد معدنی، و در ترکیبات متعدد آلی یافت می شود.
گاز اکسیژن شامل حدود 87 درصد از وزن اقیانوس ها به عنوان H2O – آب است.
ازن یا گاز اکسیژن درمانی در اروپا به مراتب بیشتر از ایالات متحده آمریکا پذیرفته شده است. تحقیقات اخیر اروپا در مورد ازن یا اکسیژن درمانی شامل مطالعات در اکسیژن کردن عضلات استراحت; درمان اختلالات عروقی و تسکین درد پشتی از دیسک های بین نخاعی است. در درمان تنفسی اکسیژن برای افزایش میزان گردش خون در خون تجویز می شود.
در بیمارستان ها برای تنفس بیماران از کپسول اکسیژن 10 لیتری استفاده میشود.

کمبود اکسیژن، همانطور که در طول صعود به ارتفاع زیاد یا در برخی بیماریها تجربه شده است. ممکن است علائم مختلف هیپوکسی یا کمبود اکسیژن را نشان دهد. تعدادی از سموم، مانند سیانید و مونوکسید کربن، می توانند سیستم توزیع اکسیژن بدن را مختل کنند. چنین اختلال هایی نیز در بیماری های مختلف مانند زیر رخ می دهد:
کشف اکسیژن به طور کلی به شیمیدان انگلیسی جوزف پریستلی مربوط می شود. در سال 1774 این عنصر را بوسیله گرمایش ترکیب جیوه و اکسیژن به نام اکسید قرمز جیوه بدست آورد. احتمالا این است که Scheele شیمیدان آلمانی-سوئدی قبلا آن را به دست آورده بود. گرچه گزارش آزمایشاتش تا سال 1777 منتشر نشده بود. آنتوان لارن لوائیسیر در سال 1777 نامگذاری شد.
جوزف پریستلی (1733-1804) یک معلم مدرسه انگلیسی، متکلم، فیلسوف و دانشمند و یک دوست بنجامین فرانکلین بود. جوزف پریستلی به عنوان کشف اکسیژن شناخته می شود. او مدافع تئوری فلوژیستون بود و اولین کسی بود که از جیوه در یک برانک پنوماتیک استفاده می کرد. بدین معنی که او ابتدا به اسید هیدروکلریک، دی اکسید گوگرد و آمونیاک گازی تبدیل شدو
اتمام اکسیژن در جدول تناوبی که هر عنصر شیمیایی را براساس عدد اتمی خود تنظیم می کند. همانطور که بر اساس قانون دوره ای است; به طوری که عناصر شیمیایی با خواص مشابه در همان ستون قرار دارند. جدول تناوبی ما ساده است برای استفاده – فقط با کلیک بر روی نماد اکسیژن; به عنوان جدول تناوبی برای اطلاعات بیشتر و برای مقایسه فوری از وزن اتمی; نقطه ذوب، نقطه جوش و جرم
جدول تناوبی استاندارد در امروز استفاده شده توسط اتحادیه بین المللی شیمی; کاربردی IUPAC در سال 1985 مورد توافق قرار گرفت. در حال حاضر عناصر و عناصر بیشتری را نسبت به دیمیتری مندلیف در روز خود در روز خود می شناسد. اما هنوز هم در مفهوم خود از “دوره ای جدول “که در آن اکسیژن تنها یک عنصر است; که می تواند یافت شود.
اکسیژن در صنعت و پزشکی مورد استفاده قرار می گیرد ولی برای جابجایی و استفاده نیاز به مخازن می باشد. شارژ اکسیژن برای کپسول هایی می باشد که از جنس فولادی ، آلومینیوم و گاها استیل می باشد. نگهداری و جابجایی در این مخازن انجام شده و بعد از مصرف گاز درون سیلندر باید اقدام به پر کردن مجدد شوید.
مجموعه ما با توجه به فعالیت در زمینه گازها ، جوش و برش انجام می گردد. شارژ کپسول اکسیژن در سایز های مختلف می باشد می توان اینگونه کپسول هر مخزنی باشد و این مهم نیست. فقط کافیست مخزن مورد نظر قابل شارژ مجدد باشد . در اینصورت ما می توانیم اینکار را برای شما انجام دهیم.
شارژ اکسیژن در گرید های صنعتی و آزمایشگاهی می تواند متفاوت باشد و هر مجموعه با توجه به نیاز و درخواست با ما در ارتباط است.
در صنعت از اکسیژن برای جوشکاری هواگاز یا هوابرش بیشتر مورد استفاده قرار می گیرد. به گونه ای که کپسول اکسیژن 40 لیتری با کپسول پروپان ادغام شده و می توان در جوشکاری و برشکاری از آن به عنوان اکسی استفاده می شود.
99/07/18
استفاده از هر گازی قابل تمام شدن است و بعد از به اتمام رسیدن باید خرید مجدد صورت بگیرد. کارخانه اکسیژن در خصوص پر کردن مجدد سیلندر ها نقش کاملی در زمینه خدمات رسانی به مشتریان خود خواهد داشت. پس از تمام شدن گاز اکسیژن درون کپسول باید به کارخانه اکسیژن مراجعه نمایید.
باید در نظر داشته باشید که پس از خرید هر کپسول اکسیژن روزی این محصول گاز درون خود را به شما پس از مصرف تمام خواهد کرد و می توانید مجدد کپسول خود را برای شارژ مجدد یا همان پر کردن برای مجموعه کپسول گاز که البته قبل از هر موضوعی اقدامات هماهنگی را انجام دهید و ارسال نمایید.
کارخانه های شارژ کپسول علاوه بر اکسیژن در سایر گازهای مصرفی نیز فعال می باشند. گاز اکسیژن به دلیل مصرف بالا در زمینه صنعت و پزشکی نسبت به سایر گازها تقاضای بیشتری داشته و شارژ کردن آن راحت تر می باشد. به همین منظوری تعداد کارخانه های اکسیژن بیشتر می باشد.
برای استفاده از این گاز نیاز به برخی از تجهیزات خواهید داشت که در این بخش به آنان اشاره خواهیم نمود و همچنین شما می توانید با کلیک بروی هر کدام به مشاهده محصول مورد نظر هدایت شوید.
یکی از گازهای پر مصرف که در صنعت و پزشکی ...
بیشتر بخوانیدبرای استفاده از هوا یا اکسیژن در جوشکاری و بیمارستانی ...
بیشتر بخوانیدکپسول 40 لیتری اکسیژن ساخت ایران توسط ما جهت فروش ...
بیشتر بخوانید